
Streszczenie
Informacje wstępne
Wirusy grypy A (IAV) wywołują na całym świecie infekcje, które co roku prowadzą do śmierci pól miliona ludzi. Te ogniska grypy pojawiają się w miesiącach zimowych w regionach o umiarkowanym klimacie. Apogeum osiągają między listopadem a marcem na półkuli północnej i między majem a wrześniem na półkuli południowej. Do epidemii tych przyczyniają się wahania temperatur, niski poziom wilgotności powietrza, stłoczenie ludzi w pomieszczeniach, brak dostępu do światła słonecznego i związany z tym niedobór witaminy D.
Rezultat
Szczegółowe badanie przeprowadzone przez Akiko Iwasaki et al. pokazuje ponownie*, że zbyt niska wilgotność powietrza znacznie podwyższa podatność na infekcje grypowe. (*Lipsitch et al. 2010, badanie na przestrzeni 30 lat)
Zbyt niska wilgotność względna powietrza, na poziomie 10–20%, prowadzi do osłabienia mechanizmu samooczyszczania dróg oddechowych, ograniczenia odporności na wirusy oraz obniżenia sprawności komórek pamięci immunologicznej. Przy wyższej wilgotności względnej powietrza (50%) powyższe zjawiska nie występują.
Trzy bariery immunologiczne do ochrony przed infekcją
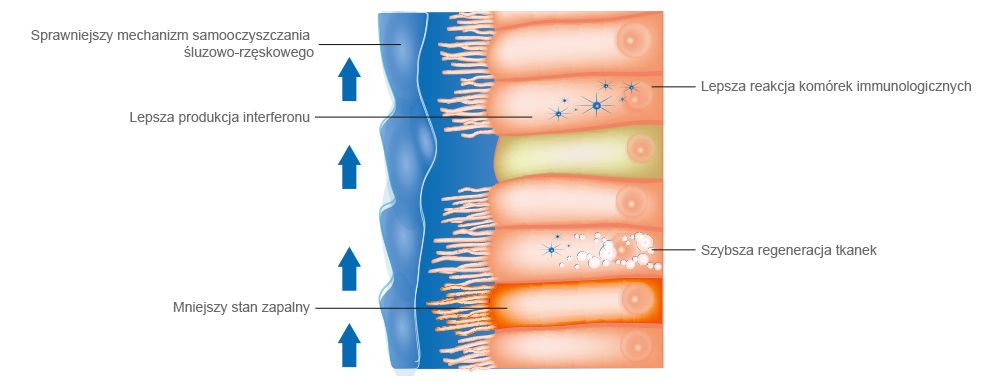
Ochronę przed infekcjami wirusowymi umożliwiają 3 bariery układu odpornościowego. 1. bariera składa się ze śluzówki, warstwy płynnej na warstwie śluzu oraz rzęsek na powierzchni śluzówki. To one umożliwiają obronę przed chorobotwórczymi drobnoustrojami i zarazkami, które przedostają się do organizmu poprzez drogi oddechowe. Gdy wirus przebije pierwszą barierę immunologiczną, uwalniany jest interferon w celu aktywowania genów, które zwalczają lub blokują wirusy. Gdy wirusowi uda się przebić również przez ten wrodzony
2. etap obrony, aktywowany zostaje 3. etap, adaptacyjny system immunologiczny, wyzwalając specyficzne dla wirusa odpowiedzi immunologiczne komórek B i T.
Te trzy bariery stają się nieskuteczne przy przebywaniu w otoczeniu o zbyt niskiej wilgotności powietrza (10–20%). Następuje zachorowanie na grypę. Choroba nasila się przy względnej wilgotności powietrza na poziomie 10–20%, niezależnie od wiremii. Dodatkowo zahamowana zostaje zdolność komórek do regeneracji.
Przy względnej wilgotności powietrza na poziomie 50% choroba grypowa charakteryzuje się łagodniejszym przebiegiem, z niższą gorączką i krótszym czasem trwania.
Badanie przeprowadzone przez dr Akiko Iwasaki
Na co wpływa wilgotność powietrza w naszym układzie odpornościowym
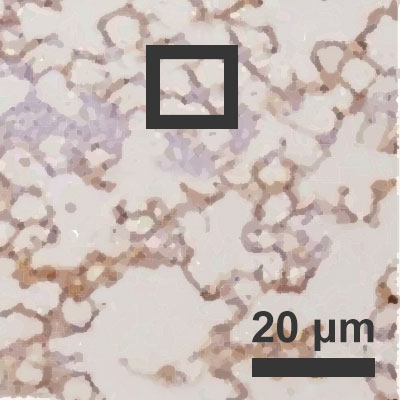 Zainfekowane pęcherzyki płucne przy wilgotności powietrza na poziomie 10%
Zainfekowane pęcherzyki płucne przy wilgotności powietrza na poziomie 10%
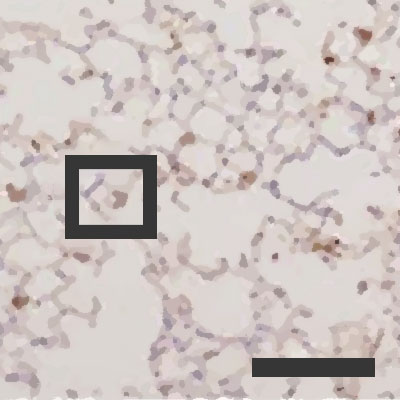 Zainfekowane pęcherzyki płucne przy wilgotności powietrza na poziomie 50%
Zainfekowane pęcherzyki płucne przy wilgotności powietrza na poziomie 50%
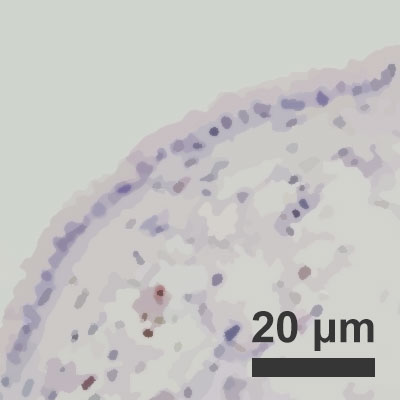 Zdolność zainfekowanych pęcherzyków płucnych do regeneracji przy wilgotności powietrza na poziomie 10%
Zdolność zainfekowanych pęcherzyków płucnych do regeneracji przy wilgotności powietrza na poziomie 10%
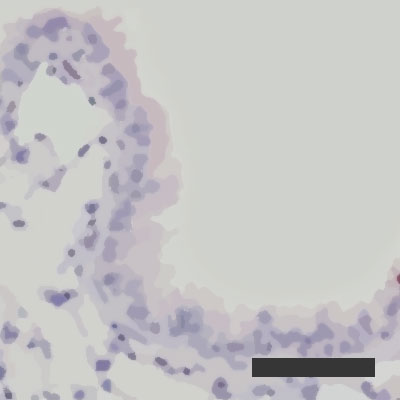 Zdolność zainfekowanych pęcherzyków płucnych do regeneracji przy wilgotności powietrza na poziomie 50%
Zdolność zainfekowanych pęcherzyków płucnych do regeneracji przy wilgotności powietrza na poziomie 50%
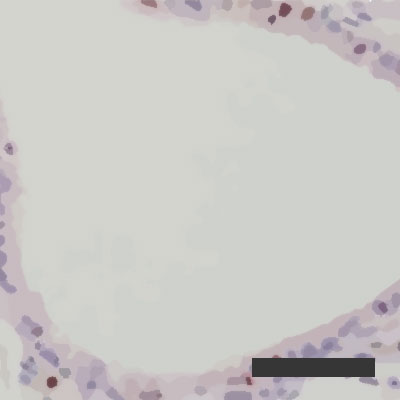 Zdolność zainfekowanych pęcherzyków płucnych do regeneracji przy wilgotności powietrza na poziomie 10%
Zdolność zainfekowanych pęcherzyków płucnych do regeneracji przy wilgotności powietrza na poziomie 10% 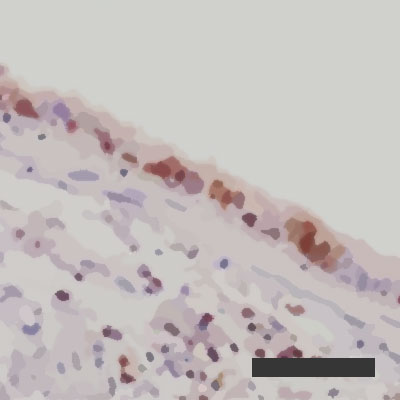 Zdolność zainfekowanych pęcherzyków płucnych do regeneracji przy wilgotności powietrza na poziomie 50%
Zdolność zainfekowanych pęcherzyków płucnych do regeneracji przy wilgotności powietrza na poziomie 50%
2 Pytania do dr Akiko Iwasaki
Jak zrównoważona wilgotność powietrza w pomieszczeniu wpływa na ludzi narażonych na kontakt z wirusem grypy?
Jak działają mechanizmy obronne związane ze zrównoważoną wilgotnością powietrza?
Już od dziesięcioleci wiemy, że fale zachorowań na grypę występują głównie zimą, gdy zachodzi konieczność ogrzewania pomieszczeń. Możliwe przyczyny występowania zachorowań na grypę w okresie zimowym były przedmiotem wielu dyskusji. Wśród wyjaśnień tej sezonowości wskazano między innymi ekspozycję na niskie temperatury, niski poziom wilgotności powietrza w pomieszczeniach, a także na zewnątrz, skupiska ludzi w pomieszczeniach z podwyższonym przenoszeniem kontaktowym lub drogą kropelkową, a także spadek poziomu witaminy D wskutek ograniczonego kontaktu ze światłem słonecznym.
Zrozumienie przyczyn sezonowej grypy i zdobycie wiedzy o środkach, jakie można podjąć w celu zmniejszenia związanego z nią prawdopodobieństwa zachorowań i zgonów, jest interesujące nie tylko z teoretycznego punktu widzenia. Temat ten jest ogromnie ważny, ponieważ sezonowe infekcje grypowe nadal przybierają na sile i co roku są przyczyną co najmniej pół miliona zgonów na świecie. Zapewnienie zrównoważonego poziomu wilgotności powietrza jest środkiem ochronnym, który stanowi dodatkowe wspomaganie dla szczepień i może być ratunkiem dla wielu ludzkich istnień.
W badaniu tym wykazano, że suche powietrze w pomieszczeniach nasila skutki grypy. Udowodniono również, że uregulowanie wilgotności względnej powietrza na poziomie 40–60% minimalizuje infekcje wirusowe i utrudnia ich rozprzestrzenianie. Jest to pierwsze badanie, które wykazuje znaczenie mechanizmów fizjologicznych dla uzyskania pozytywnych rezultatów, które można osiągnąć poprzez zapewnienie zrównoważonej wilgotności powietrza.
Jak zrównoważona wilgotność powietrza w pomieszczeniu wpływa na ludzi narażonych na kontakt z wirusem grypy?
Jak działają mechanizmy obronne związane ze zrównoważoną wilgotnością powietrza?
Już od dziesięcioleci wiemy, że fale zachorowań na grypę występują głównie zimą, gdy zachodzi konieczność ogrzewania pomieszczeń. Możliwe przyczyny występowania zachorowań na grypę w okresie zimowym były przedmiotem wielu dyskusji. Wśród wyjaśnień tej sezonowości wskazano między innymi ekspozycję na niskie temperatury, niski poziom wilgotności powietrza w pomieszczeniach, a także na zewnątrz, skupiska ludzi w pomieszczeniach z podwyższonym przenoszeniem kontaktowym lub drogą kropelkową, a także spadek poziomu witaminy D wskutek ograniczonego kontaktu ze światłem słonecznym.
Zrozumienie przyczyn sezonowej grypy i zdobycie wiedzy o środkach, jakie można podjąć w celu zmniejszenia związanego z nią prawdopodobieństwa zachorowań i zgonów, jest interesujące nie tylko z teoretycznego punktu widzenia. Temat ten jest ogromnie ważny, ponieważ sezonowe infekcje grypowe nadal przybierają na sile i co roku są przyczyną co najmniej pół miliona zgonów na świecie. Zapewnienie zrównoważonego poziomu wilgotności powietrza jest środkiem ochronnym, który stanowi dodatkowe wspomaganie dla szczepień i może być ratunkiem dla wielu ludzkich istnień.
W badaniu tym wykazano, że suche powietrze w pomieszczeniach nasila skutki grypy. Udowodniono również, że uregulowanie wilgotności względnej powietrza na poziomie 40–60% minimalizuje infekcje wirusowe i utrudnia ich rozprzestrzenianie. Jest to pierwsze badanie, które wykazuje znaczenie mechanizmów fizjologicznych dla uzyskania pozytywnych rezultatów, które można osiągnąć poprzez zapewnienie zrównoważonej wilgotności powietrza.
Autorzy
Tytuł oryginału: Low ambient humidity impairs barrier function and innate resistance against influenza infection
Łącze do źródła: www.pnas.org/content/early/2019/05/07/1902840116
Rok wydania: 13.05.2019
1. Wong GH, Goeddel DV (1986) Tumour necrosis factors alpha and beta inhibit virus replication and synergize with interferons. Nature 323:819–822.
2. Johnson NB, et al.; Centers for Disease Control and Prevention (CDC) (2014) CDC National Health Report: Leading causes of morbidity and mortality and associated behavioral risk and protective factors–United States, 2005-2013. MMWR Suppl 63:3–27.
3. Tamerius JD, et al. (2013) Environmental predictors of seasonal influenza epidemics across temperate and tropical climates. PLoS Pathog 9:e1003194, and erratum 2013 Nov;9(11).
4. Alonso WJ, et al. (2015) A global map of hemispheric influenza vaccine recommendations based on local patterns of viral circulation. Sci Rep 5:1–6.
5. Tamerius J, et al. (2011) Global influenza seasonality: Reconciling patterns across temperate and tropical regions. Environ Health Perspect 119:439–445.
6. Cannell JJ, et al. (2006) Epidemic influenza and vitamin D. Epidemiol Infect 134:1129– 1140.
7. Lowen AC, Steel J (2014) Roles of humidity and temperature in shaping influenza seasonality. J Virol 88:7692–7695.
8. Eccles R (2002) An explanation for the seasonality of acute upper respiratory tract viral infections. Acta Otolaryngol 122:183–191.
9. Shaman J, Pitzer VE, Viboud C, Grenfell BT, Lipsitch M (2010) Absolute humidity and the seasonal onset of influenza in the continental United States. PLoS Biol 8: e1000316.
10. Lowen AC, Mubareka S, Steel J, Palese P (2007) Influenza virus transmission is dependent on relative humidity and temperature. PLoS Pathog 3:1470–1476.
11. Iwasaki A, Pillai PS (2014) Innate immunity to influenza virus infection. Nat Rev Immunol 14:315–328.
12. Chen X, et al. (2018) Host immune response to influenza a virus infection. Front Immunol 9:320.
13. Garber EA, Hreniuk DL, Scheidel LM, van der Ploeg LHT (1993) Mutations in murine Mx1: Effects on localization and antiviral activity. Virology 194:715–723.
14. Staeheli P, Grob R, Meier E, Sutcliffe JG, Haller O (1988) Influenza virus-susceptible mice carry Mx genes with a large deletion or a nonsense mutation. Mol Cell Biol 8: 4518–4523.
15. Pillai PS, et al. (2016) Mx1 reveals innate pathways to antiviral resistance and lethal influenza disease. Science 352:463–466.
16. Taubenberger JK, Morens DM (2008) The pathology of influenza virus infections. Annu Rev Pathol 3:499–522.
17. Short KR, et al. (2016) Influenza virus damages the alveolar barrier by disrupting epithelial cell tight junctions. Eur Respir J 47:954–966.
18. Bustamante-Marin XM, Ostrowski LE (2017) Cilia and mucociliary clearance. Cold Spring Harb Perspect Biol 9:a028241.
19. Verhelst J, Parthoens E, Schepens B, Fiers W, Saelens X (2012) Interferon-inducible protein Mx1 inhibits influenza virus by interfering with functional viral ribonucleoprotein complex assembly. J Virol 86:13445–13455.
20. Everitt AR, et al.; GenISIS Investigators; MOSAIC Investigators (2012) IFITM3 restricts the morbidity and mortality associated with influenza. Nature 484:519–523.
21. Brass AL, et al. (2009) The IFITM proteins mediate cellular resistance to influenza A H1N1 virus, West Nile virus, and dengue virus. Cell 139:1243–1254.
22. Swiecki M, Wang Y, Gilfillan S, Lenschow DJ, Colonna M (2012) Cutting edge: Paradoxical roles of BST2/tetherin in promoting type I IFN response and viral infection. J Immunol 188:2488–2492.
23. Wang X, Hinson ER, Cresswell P (2007) The interferon-inducible protein viperin inhibits influenza virus release by perturbing lipid rafts. Cell Host Microbe 2:96–105.
24. Lenschow DJ, et al. (2007) IFN-stimulated gene 15 functions as a critical antiviral molecule against influenza, herpes, and Sindbis viruses. Proc Natl Acad Sci USA 104: 1371–1376.
25. Tang Q, Wang X, Gao G (2017) The short form of the zinc finger antiviral protein inhibits influenza A virus protein expression and is antagonized by the virus-encoded NS1. J Virol 91:e01909-16.
26. Arnheiter H, Skuntz S, Noteborn M, Chang S, Meier E (1990) Transgenic mice with intracellular immunity to influenza virus. Cell 62:51–61.
27. Kolb E, Laine E, Strehler D, Staeheli P (1992) Resistance to influenza virus infection of Mx transgenic mice expressing Mx protein under the control of two constitutive promoters. J Virol 66:1709–1716.
28. Haller O, Staeheli P, Kochs G (2007) Interferon-induced Mx proteins in antiviral host defense. Biochimie 89:812–818.
29. Allen EK, et al. (2017) SNP-mediated disruption of CTCF binding at the IFITM3 promoter is associated with risk of severe influenza in humans. Nat Med 23:975–983.
30. Randolph AG, et al.; Pediatric Acute Lung Injury and Sepsis Investigators (PALISI) Network Pediatric Influenza (PICFLU) Investigators; Pediatric Acute Lung Injury and Sepsis Investigators (PALISI) Network Pediatric Influenza (PICFLU) Investigators (2017) Evaluation of IFITM3 rs12252 association with severe pediatric influenza infection. J Infect Dis 216:14–21.
31. Mihaylova VT, et al. (2018) Regional differences in airway epithelial cells reveal tradeoff between defense against oxidative stress and defense against Rhinovirus. Cell Rep 24:3000–3007.e3.
32. Clary-Meinesz CF, Cosson J, Huitorel P, Blaive B (1992) Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biol Cell 76:335–338.
33. Daviskas E, et al. (1995) Changes in mucociliary clearance during and after isocapnic hyperventilation in asthmatic and healthy subjects. Eur Respir J 8:742–751.
34. Oozawa H, et al. (2012) Effect of prehydration on nasal mucociliary clearance in low relative humidity. Auris Nasus Larynx 39:48–52.
35. Moura FE, Perdigão AC, Siqueira MM (2009) Seasonality of influenza in the tropics: A distinct pattern in northeastern Brazil. Am J Trop Med Hyg 81:180–183.
36. Shek LP, Lee BW (2003) Epidemiology and seasonality of respiratory tract virus infections in the tropics. Paediatr Respir Rev 4:105–111.
37. Horisberger MA, Staeheli P, Haller O (1983) Interferon induces a unique protein in mouse cells bearing a gene for resistance to influenza-virus. Proc Natl Acad Sci USA 80:1910–1914.
38. Grimm D, et al. (2007) Replication fitness determines high virulence of influenza A virus in mice carrying functional Mx1 resistance gene. Proc Natl Acad Sci USA 104: 6806–6811.
39. Mastorakos P, et al. (2015) Highly compacted biodegradable DNA nanoparticles capable of overcoming the mucus barrier for inhaled lung gene therapy. Proc Natl Acad Sci USA 112:8720–8725.
40. Francis R, Lo C (2013) Ex vivo method for high resolution imaging of cilia motility in rodent airway epithelia. J Vis Exp, e50343.
41. Butler A, Hoffman P, Smibert P, Papalexi E, Satija R (2018) Integrating single-cell transcriptomic data across different conditions, technologies, and species. Nat Biotechnol 36:411–420.
42. Cohen M, et al. (2018) Lung single-cell signaling interaction map reveals basophil role in macrophage imprinting. Cell 175:1031–1044.e18.
43. Steuerman Y, et al. (2018) Dissection of influenza infection In Vivo by single-cell RNA sequencing. Cell Syst 6:679–691.e4.
44. Kudo E, et al. (2019) Low ambient humidity impairs barrier function, innate resistance against influenza infection. NCBI BioProject. Available at https://www.ncbi.nlm.nih.gov/ bioproject/PRJNA528197. Deposited March 20, 2019.
